Tercera Ley de La Termodinamica Entropía Calor

La tercera ley de la termodinámica establece que la entropía de un sistema en el cero absoluto es una constante bien definida. Esto se debe a que un sistema a temperatura cero existe en su estado fundamental, por lo que su entropía está determinada únicamente por la degeneración del estado fundamental. En 1912 Nernst estableció la ley.
ejemplos de la tercera ley de la termodinámica Brainly.lat

Un objeto o sustancia con alta entropía está muy desordenado. La entropía en el universo solo puede aumentar. La tercera ley de la termodinámica dice que la entropía de un cristal perfecto en el cero absoluto es exactamente igual a cero. El cero absoluto es la temperatura a la que las moléculas dejan de moverse o vibrar.
Tercera Ley De La Termodinamica Ejemplos Pdf Ejemplo Sencillo

La tercera ley de la termodinámica afirma que en cualquier transformación isotérmica que se cumpla a la temperatura del cero absoluto, la variación de la entropía es nula: Independientemente de las variaciones que sufran otros parámetros de estado cualquiera. El tercer principio no permite hallar el valor absoluto de la entropía.
Formulario sobre la Segunda y Tercera Ley de la Termodinámica PDF

La Tercera Ley de la Termodinámica establece que a medida que una sustancia se enfría a una temperatura cercana al cero absoluto (-273.15°C o 0 Kelvin), su entropía, que es una medida del desorden o la incertidumbre en el sistema, se aproxima a un valor constante y finito.. Esta ley postula que alcanzar el cero absoluto requeriría un número infinito de pasos, siendo inalcanzable en la.
PPT La tercera ley de la termodinámica PowerPoint Presentation, free download ID915832

Walther Nernst. El tercer principio de termodinámica, [nota 1] más adecuadamente postulado de Nernst, afirma que no se puede alcanzar el cero absoluto en un número finito de etapas. Sucintamente, puede definirse como: Al llegar al cero absoluto, 0 K, cualquier proceso de un sistema físico se detiene.; Al llegar al cero absoluto la entropía alcanza un valor mínimo y acelerado.
Formulario sobre la Segunda y Tercera Ley de la Termodinámica PDF

Estas consecuencias se resumen en la Tercera Ley de la Termodinámica. La entropía de un cristal perfectamente ordenado a 0 K es cero. Esto también sugiere que las entropías molares absolutas pueden calcularse mediante. S = ∫T o C TdT (5.7.1) (5.7.1) S = ∫ o T C T d T. donde C C esta la capacidad calorífica.
6to sec quimica TERCERA LEY DE LA TERMODINAMICA YouTube
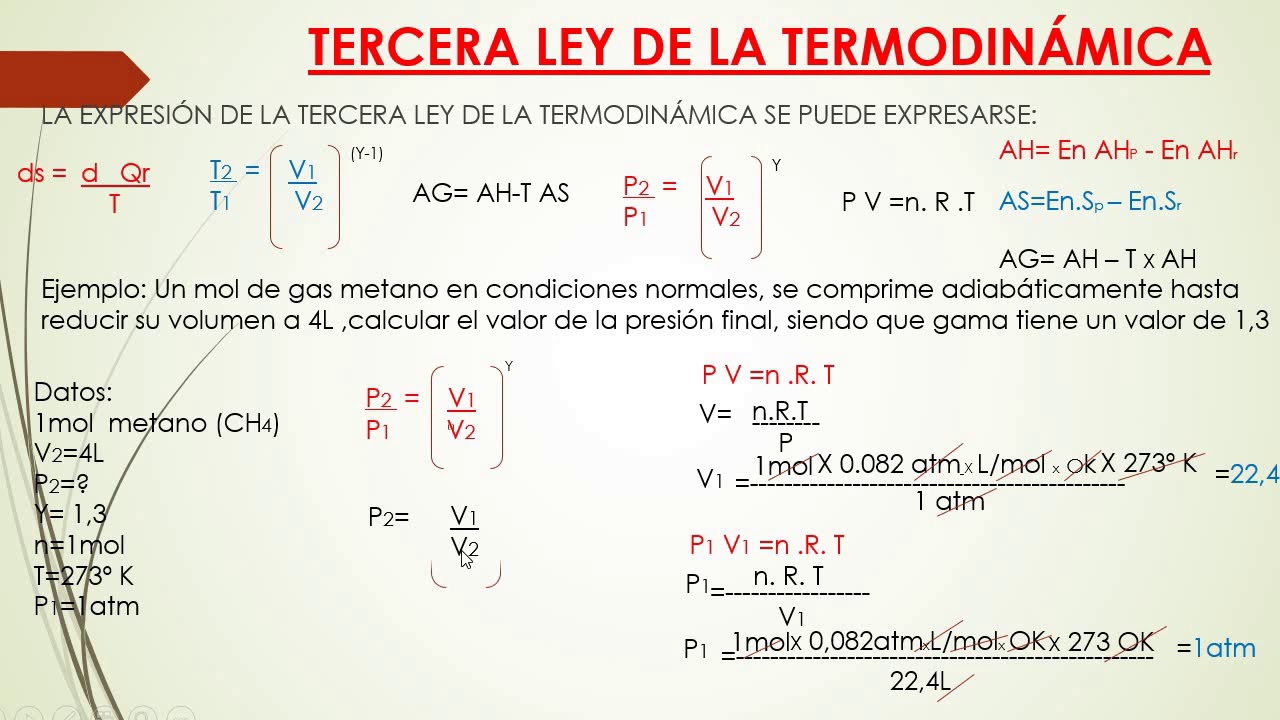
Estas fórmulas están basadas en las leyes de la Termodinámica mencionadas anteriormente. Las principales fórmulas de Termodinámica son: Calor específico máximo: C max = Q max / mT max. Trabajo específico: W spec = (FV 2 - FV 1) / m. Energía específica: E spec = U / m.
Tercera Ley de La Termodinámica Entropía Termodinámica

La Tercera ley de la termodinámica es también conocida como Postulado de Nernst y tiene que ver con términos como entropía, cero absoluto y escala Kelvin. Conoce de qué se trata y cuáles son sus aplicaciones. Explicación de la Tercera ley de la termodinámica. La entropía de un sistema se aproxima a un valor constante a medida que su temperatura se acerca al cero absoluto.
Tercera ley de la termodinamica.docx Correlación y dependencia Análisis de regresión

La Tercera Ley de la Termodinámica es uno de los principios fundamentales de la física que se aplica al estudio de la energía y el calor en los sistemas. Esta ley establece que es imposible alcanzar la temperatura de cero absoluto (0 K o -273.15 °C) en un número finito de pasos. Además, establece que la entropía de un sistema en.
Tercera ley de la termodinámica Cursos Online Web
La segunda ley de la termodinámica. En la búsqueda de una propiedad que pueda predecir de forma fiable la espontaneidad de un proceso, se ha identificado un candidato prometedor: la entropía. Los procesos que implican un aumento de la entropía del sistema (Δ S > 0) suelen ser espontáneos; sin embargo, abundan los ejemplos de lo contrario.
¿Qué Es La Tercera Ley De La Termodinamica? Varios Ejemplos

La tercera ley de la termodinámica a veces se afirma de la siguiente manera: La entropía de un cristal perfecto a cero absoluto es exactamente igual a cero. A cero kelvin el sistema debe estar en un estado con la mínima energía posible, así esta afirmación de la tercera ley se mantiene cierta si el cristal perfecto tiene sólo un estado.
Termodinámica Temperaturas y escalas termométricas
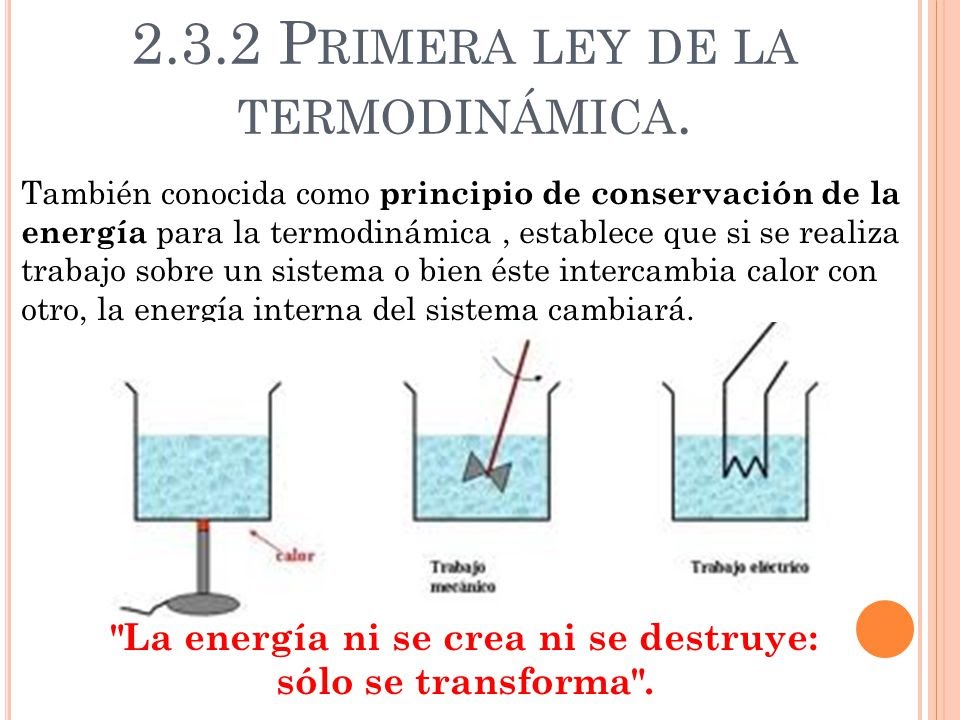
Tercera ley de la termodinámica: fórmulas, ecuaciones, ejemplos. La tercera ley de la termodinámica establece que la entropía de un sistema termodinámico cerrado en equilibrio tiende a ser mínima y constante, a medida que su temperatura se acerca a 0 kelvin. Dicho valor de la entropía será independiente de las variables del sistema (la.
Termodinámica Tercera Ley de la Termodinámica
Si Δ S univ < 0, el proceso es no espontáneo, y si Δ S univ = 0, el sistema está en equilibrio. La tercera ley de la termodinámica establece el cero para la entropía como el de un sólido cristalino perfecto y puro a 0 K. Con solo un microestado posible, la entropía es cero.
Formulario sobre la Segunda y Tercera Ley de la Termodinámica

1.6.-. Tercera Ley de la Termodinámica. Unidad 1: Termodinámica química. La tercera ley de la termodinámica es una extensión de la segunda ley y se relaciona con la determinación de los valores de la entropía. Hasta ahora hemos venido relacionado la entropía con el desorden molecular, cuanto mayor sea el desorden o la libertad de.
PPT La tercera ley de la termodinámica PowerPoint Presentation, free download ID915832
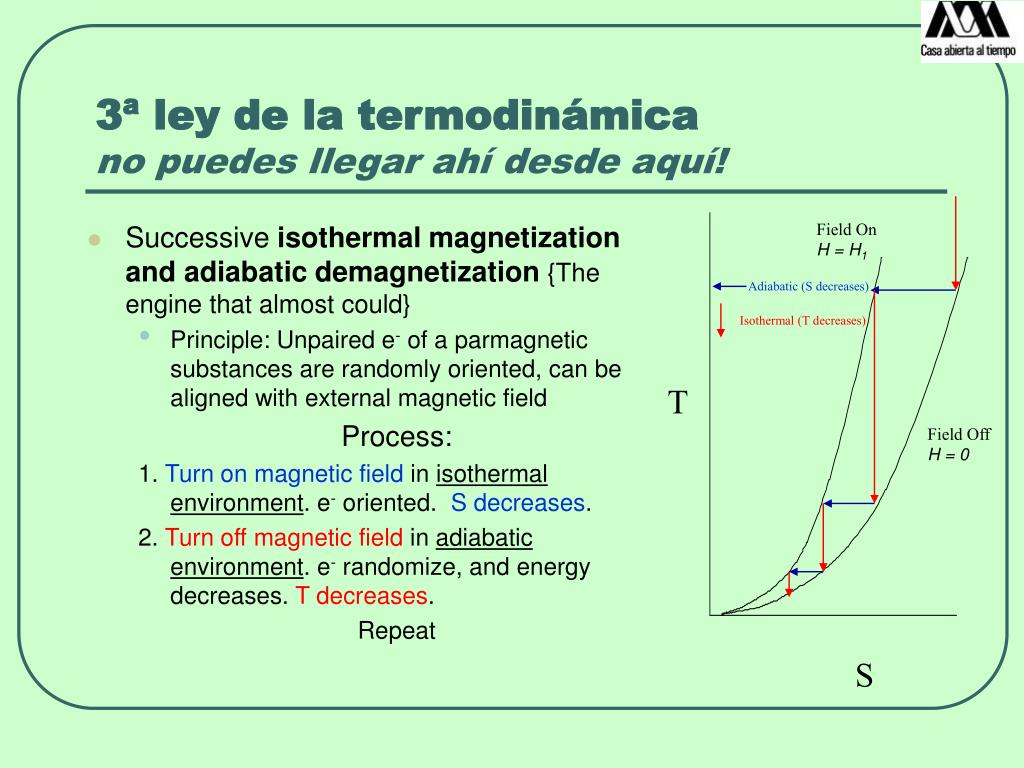
Ejemplos de la tercera ley de la termodinámica. Ejemplo 1: el cero absoluto y la indeterminación de Heisenberg. El principio de indeterminación de Heisenberg establece que la incertidumbre en la posición y el momentum de una partícula, por ejemplo, en los átomos de una red cristalina, no son independientes una de del otro, sino que siguen la siguiente desigualdad: Δx ⋅ Δp ≥ h.
FISICOQUÍMICA 3º SECUNDARIA Equilibrio térmico concepto de temperatura

Como se puede ver, la tercera ley de la termodinámica establece que la entropía de un sistema en equilibrio termodinámico se aproxima a cero cuando la temperatura se acerca a cero. O, por el contrario, la temperatura absoluta de cualquier sustancia cristalina pura en equilibrio termodinámico se aproxima a cero cuando la entropía se acerca.