ejemplos de acidos y bases segun la teoria de bronsted lowry Ejemplo Interesante

La naturaleza anfótera del agua. La esencia de la teoría de Brønsted-Lowry es que un ácido solo existe como tal en relación con una base, y viceversa. El agua es anfótera, ya que puede actuar como un ácido o como una base. En la imagen que se muestra a la derecha, una molécula de actúa como una base y gana para convertirse en.
Teoría ÁcidoBase de Arrhenius, BrönstedLowry y Lewis YouTube

La Base de Bronsted es una teoría que se relaciona con las reacciones químicas en las que los ácidos transfieren protones a las bases. También se conoce como la Teoría de la Acidez y la Basicidad de Bronsted. Fue propuesta por Johannes Nicolaus Bronsted y Thomas Martin Lowry en 1923, de manera independiente. Según esta teoría, un ácido.
Equilibrio Acido Y Bases Fuertes

Identificar bases y ácidos de Brønsted-Lowry. En la reacción entre el agua y el ácido nítrico, el ácido nítrico, HNO 3 , dona un protón (en azul) al agua, de tal forma que actúa como un ácido de Brønsted-Lowry. H NO 3 ( a c) + H 2 O ( l) → H 3 O + ( a c) + NO 3 − ( a c) Puesto que el agua acepta el protón del ácido nítrico.
teoría de la reacción ácidobase de bronstedlowry. Ilustración vectorial científica aislada
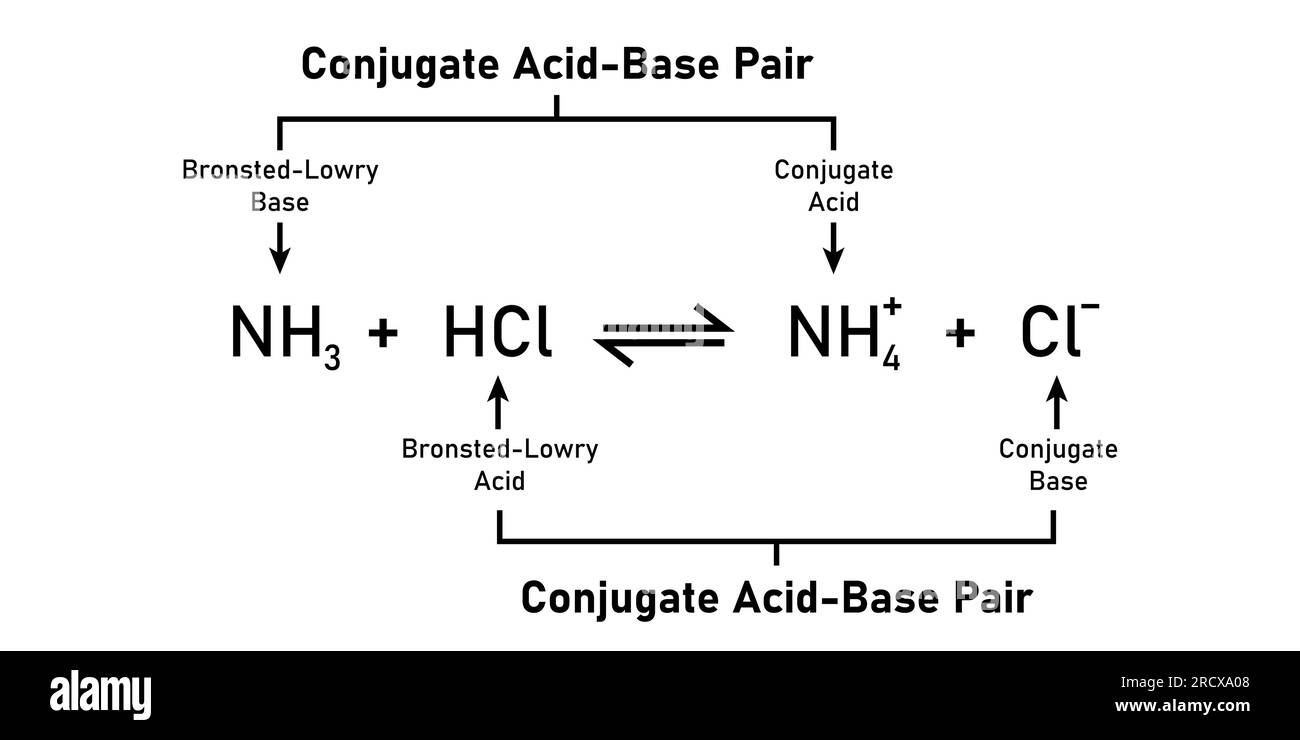
Un ácido de Brønsted-Lowry es un dador de protones, mientras que una base de Brønsted-Lowry es un aceptor de protones. Los ácidos más comunes son HCl, H2SO4 y HNO3. Las bases más comunes son NaOH y NH3. Un ácido conjugado es una base que ha aceptado un protón de un ácido, mientras que una base conjugada es un ácido que ha perdido un.
Ácidos y Bases teorías de Arrhenius, BrönstedLowry y Lewis Quimica, Ácidos, Teoria

⭐️ En Scienza Educación tenemos muchas VIDEOCLASES de matemáticas y ciencias experimentales para que tu desarrollo académico a nivel secundaria, bachillerato.
SEMANA 12 CIDOS BASES Y ELECTROLITOS QUMICA 2019

A Teoria de Brønsted-Lowry descreve as interações ácido base em termos de transferência de prótons entre as espécies químicas. Um ácido de Brønsted-Lowry é qualquer espécie capaz de doar um próton H + , e uma base é qualquer espécie capaz de aceitar um próton. Em termos de estrutura química, isso significa que qualquer ácido.
¿Cómo se forman los Ácidos, Bases y Sales?
En sentido inverso, un ion de hidróxido actúa como base al aceptar un protón del ion de amonio, que actúa como ácido. La reacción entre un ácido de Brønsted-Lowry y el agua se denomina ionización de ácidos. Por ejemplo, cuando el fluoruro de hidrógeno se disuelve en el agua y se ioniza, los protones se transfieren de las moléculas.
Bronsted Lowry Acid and Base Theory

¡Buenas tardes Amigos de la Química!Instagram con curiosidades químicas y avisos de vídeos: AmigosdelaquimicaEn el siguiente vídeo vamos a ver las teorías de.
Acidos Y Bases De Lewis Ejemplos Blogan

Aqui trataremos de três delas, que foram: teoria de Arrhenius, teoria ácido-base de Brønsted-Lowry e a teoria ácido-base de Lewis. Vejamos cada uma em mais detalhes: * Teoria ácido-base de Arrhenius: Essa foi a primeira das teorias ácido-base a ser criada, sendo que isso ocorreu no ano de 1887 pelo químico sueco Svante Arrhenius.
PPT 2 TEORÍAS ACIDOBASE PowerPoint Presentation, free download ID6207874

The Brønsted-Lowry theory (also called proton theory of acids and bases [1]) is an acid-base reaction theory which was first developed by Johannes Nicolaus Brønsted and Thomas Martin Lowry independently in 1923. [2] [3] The basic concept of this theory is that when an acid and a base react with each other, the acid forms its conjugate.
PPT Reacciones ácido base PowerPoint Presentation, free download ID6208030

La teoría Bronsted-Lowry es una herramienta clave para la comprensión de las reacciones ácido-base en química. Esta teoría se basa en la idea de que los ácidos son sustancias que donan protones (iones H+) y que las bases son sustancias que aceptan protones. Una de las principales características de la teoría de Bronsted-Lowry es su.
Teoria ácidobase de BronstedLowry YouTube

Diferentemente da teoria de Arrhenius, na de Brönsted-Lowry um ácido pode atuar como uma base, o conceito de ácido e base é relativo: dependem da espécie química com a qual a substância está reagindo para saber se ela é acida ou básica. Por exemplo, no caso acima, a água foi a base, mas se ela estiver reagindo com a amônia, ela se.
BronstedLowry AcidBase Equilibrium — Organic Chemistry Tutor
La teoria di Brønsted-Lowry è una teoria sulle reazioni acido-base formulata nel 1923 da Johannes Nicolaus Brønsted e Thomas Martin Lowry . Secondo Brønsted e Lowry, un acido è una specie chimica capace di donare uno ione H + ad un'altra specie chimica; similmente, una base è una specie chimica capace di accettare uno ione H + da un'altra.
Descubre la Teoría Ácido en Química Todo lo que Necesitas Saber ★ Teoría Online

Según la Teoría de Brönsted y Lowry, las reacciones entre ácidos y bases son reacciones de transferencia de protones H+: Ácido + Base ↔ Base conjugada + Ácido conjugado. Base conjugada: ion o molécula resultante del ácido que pierde el protón. Ácido conjugado: ion o molécula resultante de la base que gana el protón.
⚠️Teorías ÁcidoBase Arrhenius, BronstedLowry, Lewis⚠️ [Fácil y Rápido] QUÍMICA YouTube

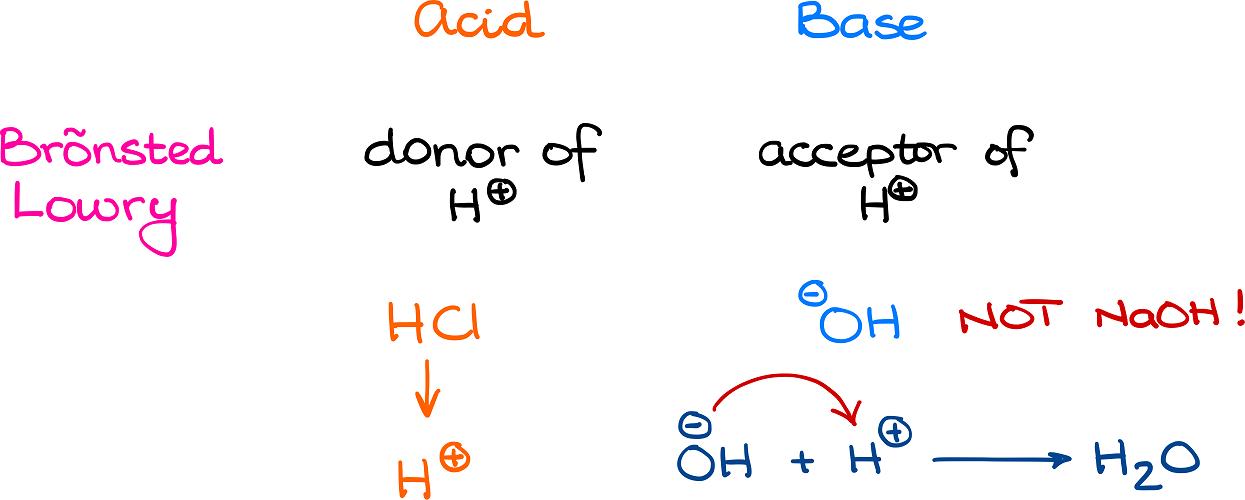
Una base de Bronsted-Lowry es un aceptador de protones. Podemos ver que cuando Bronsted-Lowry 'acepta' el ion hidrógeno (H +) proveniente del ácido, el ion hidrógeno (H +) se adhiere a la base de Bronsted-Lowry. El protón (ion H +) tiene una carga de uno positivo, por lo que cuando la base (B) acepta el protón, su carga aumenta en uno.
Teorías ácido base (Arrhenius, BronstedLowry, Lewis) YouTube

Ejemplo 12.3.1 12.3. 1. Identificar el ácido de Brønsted-Lowry y la base de Brønsted-Lowry en esta ecuación química. C6H5OH +NH−2 C6H5O− +NH3 C 6 H 5 OH + NH 2 − C 6 H 5 O − + NH 3. Solución. La molécula C 6 H 5 OH está perdiendo un H +; es el donante de protones y el ácido de Brønsted-Lowry.